En esta práctica queremos observar la influencia de la concentración y la temperatura en la velocidad de reacción.
La reacción química entre el tiosulfato de sodio (Na₂S₂O₃) y el acido clorhídrico (HCl) puede durar un tiempo considerable. En la misma se produce azufre (S) que enturbia la reacción y se desprende dióxido de azufre (SO₂) según: Na₂S₂O₃ (dis. ac.) + 2HCl (dis. ac.) → H₂O + SO₂ (g) + S (coloidal).
 Puede determinarse la velocidad de reacción estableciendo el tiempo requerido para que la solución alcance cierto grado de turbidez, en nuestro caso tomamos el momento en el cual una cruz negra dibujada debajo del recipiente en el que se produce la reacción deja de ser visible cuando se la observa a través de la misma.
Puede determinarse la velocidad de reacción estableciendo el tiempo requerido para que la solución alcance cierto grado de turbidez, en nuestro caso tomamos el momento en el cual una cruz negra dibujada debajo del recipiente en el que se produce la reacción deja de ser visible cuando se la observa a través de la misma.
Los materiales necesarios para la realización de la práctica son: un matraz Erlenmeyer, una probeta, un cronómetro, un mechero, una cruz y una pipeta y los productos son Ácido clorhídrico 2M, Tiosulfato de sodio (40 gr/litro) y agua destilada. Después de tener todo esto, nos podemos poner ¡manos a la obra!:
1ª EXPERIENCIA: INFLUENCIA DE LA CONCENTRACIÓN Se va estudiar la reacción entre el tiosulfato sódico (Na₂S₂O₃) y el acido clorhídrico (HCl) siendo el tiempo que tarda en aparecer el azufre coloidal el que marque la velocidad de la reacción. El procedimiento es el siguiente:
Se va estudiar la reacción entre el tiosulfato sódico (Na₂S₂O₃) y el acido clorhídrico (HCl) siendo el tiempo que tarda en aparecer el azufre coloidal el que marque la velocidad de la reacción. El procedimiento es el siguiente:
1º. Se toman 50 ml de disolución de tiosulfato sódico y se colocan en un matraz Erlenmeyer.
2º. Se añaden 6 ml de acido clorhídrico con una pipeta y, al mismo tiempo, se pone en marcha el crónometro.
3º. Se agita suavemente el Erlenmeyer a intervalos regulares de tiempo y se coloca sobre el papel con la cruz ya marcada. 4º. Se mira la cruz marcada a través de la disolución y cuando se deje de ver se para el cronómetro anotando el tiempo transcurrido para la reacción.
Representando los datos obtenidos, nos resulta la siguiente gráfica dónde observamos como a medida que disminuye la cantidad de Na₂S₂O₃, va aumentando el tiempo de reacción, tardando cada vez más en desaparecer la cruz marcada en el papel, es decir, la velocidad de reacción está disminuyendo.
Uno de los factores que afectan a la velocidad de reacción es la concentración. La velocidad de reacción depende directamente de este factor ya que a más cantidad de sustancia, mayor número de moléculas y por tanto mayor es la probabilidad de que estas choquen y se produzca reacción. En este caso vemos que cuando aumentamos la cantidad de Na₂S₂O₃ disminuye el tiempo de reacción por lo que aumenta la velocidad, produciéndose la reacción cada vez más rápido.
2ª EXPERIENCIA: INFLUENCIA DE LA TEMPERATURA
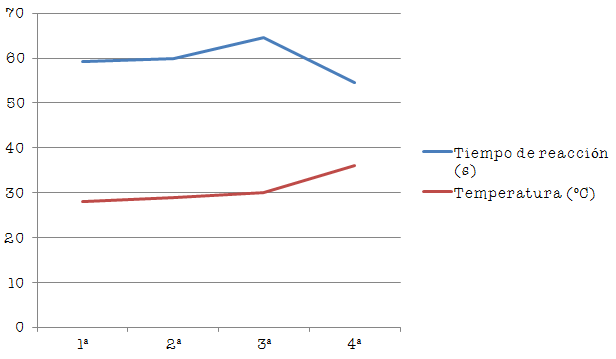
En esta segunda parte, repetimos la experiencia sin modificar la concentración de los reactivos, y solo variando la temperatura de la reacción. Para ello antes de añadir el acido clorhídrico hay que calentar la disolución de 10 ml de tiosulfato sódico y 40 ml de agua destilada y realizarla a las temperaturas aproximadas de 20ºC, 30ºC, 40ºC y 50ºC, obteniendo los resultados que muestra la tabla adjunta:
Representando los datos obtenidos, nos resulta la siguiente gráfica dónde observamos que a medida que la temperatura aumenta, disminuye el tiempo de reacción y, por lo tanto, aumenta la velocidad.
Según la teoría cinético-molecular, al aumentar la temperatura aumenta la energía cinética de las moléculas de sustancia y por lo tanto aumenta la velocidad de reacción, haciendo que haya mayor número de choques entre las moléculas. Por lo tanto al aumentar el número de choques, se produce antes la reacción, en este caso observamos como desaparece la cruz marcada en el papel cada vez más rápido.
Durante el desarrollo de la práctica nos encontramos con algunos inconvenientes: a la hora de realizar la segunda experiencia calentábamos el agua cada vez a una mayor temperatura, sin embargo, el espacio donde la calentábamos, estaba alejado de donde estábamos realizando la experiencia, por lo que en el desplazamiento pudo perderse parte del calor obtenido, por lo que las mediciones de temperatura no serían totalmente exactas. De ahí que las temperaturas de las experiencias 2 y 3 no sean totalmente coherentes en lo referente a la teoría cinético-molecular. En general, la práctica ha dado los resultados esperados.
Aquí nos podéis ver haciendo la práctica paso a paso, con los resultados obtenidos y una más que divertida explicación del proceso:
GRUPO I: Miguel Salazar, Laura López, María José García, Sergio Fernández y Estela Torres, 2ºBachillerato-B
Aquí nos podéis ver haciendo la práctica paso a paso, con los resultados obtenidos y una más que divertida explicación del proceso: